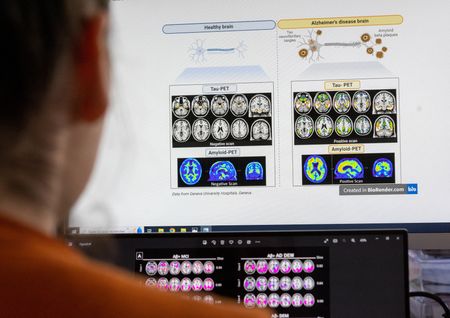
Frankfurt (Reuters) – Der US-Biotechkonzern Biogen und sein japanischer Partner Eisai scheitern mit einer Zulassung ihres Alzheimer-Medikaments Leqembi in Europa.
Die EU-Arzneimittelbehörde EMA lehnte am Freitag eine Zulassung des Mittels ab. Der zuständige Ausschuss CHMP befand, dass die beobachtete Wirkung von Leqembi hinsichtlich der Verzögerung des kognitiven Abbaus das Risiko schwerwiegender Nebenwirkungen nicht aufwiege. Dazu zähle insbesondere das Auftreten einer potenziell tödlichen Hirnschwellung.
Für die beiden Arzneimittelhersteller ist das ein herber Rückschlag, zumal das in den USA zugelassene Medikament dort nur zögerlich angenommen wird. Die Aktien von Biogen fielen im vorbörslichen Handel in den USA um mehr als sechs Prozent. Eisai und Biogen erklärten, dass sie eine erneute Prüfung anstreben. “Wir sind sehr enttäuscht über die negative Stellungnahme des CHMP und verstehen, dass dies auch für die breitere Alzheimer-Gemeinschaft enttäuschend sein könnte”, erklärte Lynn Kramer, Chief Clinical Officer von Eisai.
Der Antikörper Lecanemab, der unter dem Namen Leqembi vermarktet wird, sollte das erste Medikament in Europa sein, das die neurodegenerative Erkrankung und nicht deren Symptome behandelt. Leqembi zielt darauf ab, das Fortschreiten von Alzheimer zu verlangsamen, indem es Ablagerungen des Proteins Beta-Amyloid aus dem Gehirn entfernt. Bisherige Arzneien behandeln nur die Symptome, ändern aber nicht den Verlauf der Krankheit.
Experten hatten sich bereits skeptisch gezeigt, dass der Nutzen von Leqembi dessen gesundheitliche Risiken womöglich nicht aufwiegt. Studien hatten gezeigt, dass das Mittel den kognitiven Verfall bei Alzheimer-Patienten im frühen Stadium der Krankheit um 27 Prozent verlangsamt. Für bestimmte Patienten birgt die Behandlung jedoch schwere Nebenwirkungen, denn bei fast 13 Prozent der rund 1800 Patienten umfassenden Studie wurde Leqembi mit einer gefährlichen Art von Gehirnschwellung in Verbindung gebracht. In Europa leben schätzungsweise sieben Millionen Menschen mit Alzheimer. Die Markteinführung von Leqembi in den USA verlief bisher eher schleppend, mit Engpässen aufgrund von Anforderungen wie zusätzlichen diagnostischen Tests, zweimonatlichen Infusionen und regelmäßigen Gehirnscans.
Der US-Pharmakonzern Eli Lilly hatte Anfang des Monats in den USA grünes Licht für sein Medikament Donanemab erhalten, das unter dem Markennamen Kisunla vertrieben und zur Behandlung von Alzheimer im Frühstadium eingesetzt wird. Die Arznei war damit die zweite Therapie zur Verlangsamung des Fortschreitens der Krankheit, die Patienten in den USA zur Verfügung steht.
(Bericht Manas Mishra in Bangalore und Patricia Weiß. Redigiert von Philipp Krach. Bei Rückfragen wenden Sie sich bitte an unsere Redaktion unter berlin.newsroom@thomsonreuters.com (für Politik und Konjunktur) oder frankfurt.newsroom@thomsonreuters.com (für Unternehmen und Märkte).)